El
equilibrio químico se establece siempre que estén
produciendo dos procesos que tienen lugar a la misma velocidad.
Ejemplos de procesos contrarios y simultáneos:
• Evaporación de
un líquido en un recipiente cerrado (presión de vapor).
• Disolución de
un soluto.
2.
Constante de equilibrio.
Ejemplo de proceso
reversible: Síntesis del metanol CO(g) + 2 H2(g) → CH3OH(g)
Inicialmente sólo
tiene lugar la reacción directa, pero en cuanto se forma
algo de metanol, tiene lugar la reacción inversa. CH3OH(g) →
CO(g) + 2 H2(g)
Al pasar el tiempo
disminuye la velocidad de la reacción directa, porque disminuyen las
concentraciones de los reactivos.
La reacción inversa
aumenta la velocidad, hasta que llega un momento que las velocidades
se igualan y alcanza una situación de proceso dinámico.
L a
relación entre las cantidades ya en el equilibrio tiene la expresión
conocida como constante de equilibrio (Kc). La Kc se basa en
concentraciones. Esta se relación se cumplirá siempre que sean
cantidades bajas, pues es una aproximación.
a
relación entre las cantidades ya en el equilibrio tiene la expresión
conocida como constante de equilibrio (Kc). La Kc se basa en
concentraciones. Esta se relación se cumplirá siempre que sean
cantidades bajas, pues es una aproximación.
 a
relación entre las cantidades ya en el equilibrio tiene la expresión
conocida como constante de equilibrio (Kc). La Kc se basa en
concentraciones. Esta se relación se cumplirá siempre que sean
cantidades bajas, pues es una aproximación.
a
relación entre las cantidades ya en el equilibrio tiene la expresión
conocida como constante de equilibrio (Kc). La Kc se basa en
concentraciones. Esta se relación se cumplirá siempre que sean
cantidades bajas, pues es una aproximación.
La
verdadera constante de equilibrio termodinámica (Keq)
no depende de las concentraciones, sino de la relación entre la
actividad de los reactivos y productos.
*¿Cómo
cambia la constante de equilibrio al modificar la reacción?
-Cuando
se multiplican los coeficientes de una ecuación ajustada por un
número, la constante de equilibrio estará elevada a ese número.
-Cuando
se dividen los coeficientes de una ecuación ajustada por un
número,se extrae de la correspondiente raíz de la constante de
equilibrio.
-Cuando se invierte
una ecuación, la nueva constante de equilibrio es la inversa de la
primera constante de equilibrio.
-Cuando
se suman reacciones las constantes de equilibrio se multiplican.
En
caso de reacciones entre gases, se pueden utilizar las presiones
parciales de las concentraciones: Kp.
Se describe la composición en términos de presiones parciales. Para
ello hay que adaptar la expresión de la constante de equilibrio y
referirla, a presiones parciales Kp. Kp y Kc se relacionan mediante
la ley de los gases ideales:
PV = nRT →
P = (n/V) RT →
P = cRT
La
constante de equilibrio solo incluye término donde la composición o
presiones parciales se modifiquen durante la reacción. Es decir, un
sólido puro o un líquido NO se incluyen, dado que la concentración
de una sustancia pura no puede modificarse.
Ejemplo:
Especifica la presión parcial de Hg (líquido, a temp ambiente se
evapora) en su evaporación.
Sólo
se incluye el segundo elemento de la ecuación (gas), dado que el
primero es un líquido. Hg(l) ↔ Hg (g)
*¿Qué
información nos da Kp o Kc?
-Un valor muy grande
de Kp o Kc significa que la reacción directa transcurre por
completo, porque está extremadamente desplazado hacia la derecha
(→). Más beneficiosa industrialmente.
-Un valor muy pequeño
significa que la reacción directa no se da, porque está muy
desplazada hacia la izquierda( ←)
-Para que haya
equilibrio Kc o Kp tienen que estar entre 10-10 o 1010.
4.
¿Cómo predecir el sentido de una ecuación: Qc?
El cociente de reacción
coincide con la expresión de la constante de equilibrio, pero con la
diferencia de que puede ser evaluado en cualquier instante de la
reacción y valor de concentración, no sólo en equilibrio. Nos
indica hacia dónde se desplaza la reacción.
Si Q = Kc , el sistema
está en equilibrio.
Si Q < Kc ,
significa que el cociente de las concentraciones iniciales es menor
que el que debería ser en el equilibrio. La reacción se desplaza
hacia →,
para incrementar la concentración de productos, ya que así se
reducen la de reactivos.
Si Q > Kc , el
valor del cociente de las concentraciones iniciales es superior al
que corresponde al estado de equilibrio. La reacción se desplaza
hacia ←
para igualar las concentraciones.
5.
Principio de Lechatelier: Modificación de las condiciones de
equilibrio.
Ante cualquier
modificación de la temperatura, presión o temperatura de las
especies en un sistema de equilibrio, el sistema responde
estableciendo
un nuevo equilibrio que contrarreste parcialmente la modificación.
¿Cómo
influye la variación de la concentración?
*Si se aumenta
[Product], el sistema para contrarrestarlo, evoluciona hacia la
izquierda (←)
de tal manera que la reacción neta consume la sustancia añadida.
*Si se aumenta
[React], el equilibrio se desplazará hacia la derecha (→),
disminuyendo la concentración de los reactivos y aumentando la de
los productos.
El estrés en la
concentración que se realiza al añadir un reactivo o un producto a
un sistema en equilibrio es contrarestado por una reacción neta en
la dirección que consume la sustancia añadida.
Si se elimina alguna
sustancia el sistema evolucionará hacia ese lado para producir más
cantidad de dicha sustancia y restablecer el equilibrio. Así si el
estrés de concentración es originado por la eliminación de un
reactivo o un producto, este es contrarestado por la reacción neta
en la dirección que produce reponiendo el producto eliminado.
¿Cómo
se modifica la presión y cómo influye en la reacción?
1.
Añadiendo o retirando reactivo o producto gaseoso.
Se modifica igual que
con la variación de la concentración.
2. Añadiendo un gas
inerte.
La presión total
aumenta, pero las parciales permanecen constantes, así que el
equilibrio no se modifica.
3. Cambiando el volumen
del sistema.
-Si
V↑,
P↓,
se desplaza el equilibrio hacia donde se produzca mayor
nº de moles de gas.
-Si
V↓, P↑,
se desplaza el equilibrio hacia donde se produce un menor
nº de moles de gas.
Los cambios de presión
no afectan al equilibrio cuando ∆n
= 0, ya que, en este caso, el número de moles gaseosos a ambos lados
de la ecuación es idéntico. Tampoco afectan cuando sólo hay
sólidos y líquidos puesto que son incompresibles.
¿Cómo
influye la variación de temp?
Si
temp ↑, el equilibrio se
desplaza hacia donde la reacción es endotérmica (absorbe
calor) para equilibrar el medio.
Si
temp ↓,
el equilibrio se desplaza hacia donde
la reacción es exotérmica
(emite
calor) para equilibrar el medio.
Se
puede establecer relación cuantitativa entre la constante de
equilibrio y la temperatura: ΔG°
= ΔH° -TΔS° ΔG° = -RTln (Keq)
L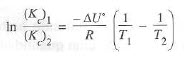 a
ecuación de Van’t Hoff es
comúnmente utilizada para determinar los valores de constantes de
equilibrio a una cierta temperatura a partir de los valores de otra
temperatura. También ofrece medios de obtener calores de reacción
cuando las constantes de equilibrio son conocidas en dos
temperaturas.
a
ecuación de Van’t Hoff es
comúnmente utilizada para determinar los valores de constantes de
equilibrio a una cierta temperatura a partir de los valores de otra
temperatura. También ofrece medios de obtener calores de reacción
cuando las constantes de equilibrio son conocidas en dos
temperaturas.
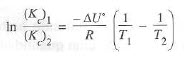 a
ecuación de Van’t Hoff es
comúnmente utilizada para determinar los valores de constantes de
equilibrio a una cierta temperatura a partir de los valores de otra
temperatura. También ofrece medios de obtener calores de reacción
cuando las constantes de equilibrio son conocidas en dos
temperaturas.
a
ecuación de Van’t Hoff es
comúnmente utilizada para determinar los valores de constantes de
equilibrio a una cierta temperatura a partir de los valores de otra
temperatura. También ofrece medios de obtener calores de reacción
cuando las constantes de equilibrio son conocidas en dos
temperaturas.
Otra forma de la
ecuación de Van’t Hoff describe el cambio de la constante de
equilibrio hacia la concentración Kc con la temperatura:
Efecto
de un catalizador.
El equilibrio no varía,
sólo varía la cinética de la reacción en ambos sentidos, es
decir, simplemente la reacción alcanza el equilibrio más rápido.
6.
Cálculo de equilibrios.
A/Determinar el sentido
de desplazaminento (Qc)
B/Determinar las
cantidades iniciales (concentraciones, presiones parciales, etc)
C/Representar
por x el
cambio necesario para alcanzar el equilibrio.
D/ Comprobar la
estequiometría de la reacción.
E/Relacionar las nuevas
concentraciones en el equilibro a través de la constante de
equilibrio.
F/Resolver
la ec. resultante para hallar x.
No hay comentarios:
Publicar un comentario