Entre
1916-19, G. N. Lewis, I. Langmuir y W. Kossel formularon
una propuesta sobre el enlace químico: Teoría de Lewis
• Los
electrones de valencia juegan un papel fundamental en el enlace
químico.
• La
transferencia de electrones conduce a los enlaces iónicos.
• La
compartición de electrones lleva a los enlaces covalentes
(introducido por Langmuir).
• Los
electrones se transfieren o se comparten de manera que los
átomos adquieren una configuración de gas noble: octeto.
Estructuras
de Lewis.
Lewis
desarrolló un conjunto de símbolos para su teoría.
Un
símbolo de Lewis consiste en un símbolo químico que
representa el núcleo y los electrones internos de un
átomo y unos puntos situados alrededor del símbolo
representan los electrones de valencia o electrones más
externos.
El
enlace entre un átomo de hidrógeno y un átomo de cloro implica
la compartición de electrones. Esta compartición da lugar a un
enlace covalente.
• Los
círculos de trazos representan las capas electrónicas externas
de los átomos enlazantes.
•El
número de puntos que hay sobre cada circunferencia representa el
número efectivo de electrones de cada capa de valencia.
• Los
electrones compartidos los contamos dos veces, ese par de electrones
compartidos constituye el enlace covalente.
Regla
del octeto
Para
formar una estructura de Lewis es requisito tener ocho electrones
en la capa de valencia para cada. No obstante, el átomo de H es
una excepción a esta regla porque sólo puede tener dos
electrones en la capa de valencia.
La
compartición de un par de electrones entre átomos enlazados da
lugar a un enlace covalente simple.
Enlaces
covalentes coordinados
Un
enlace covalente en el que uno de los átomos
contribuye con ambos electrones del par compartido
se denomina un enlace covalente coordinado.
No
se puede distinguir entre un enlace covalente coordinado y uno
normal.
Enlaces
covalentes múltiples
Los
átomos enlazados comparten entre sí dos o tres pares de
electrones, constituyendo un
enlace covalente doble o triple (múltiple).
Polaridad
y electronegatividad
Enlace
covalente polar: aquel en el
que dos átomos no comparten por igual los electrones. En
estos enlaces, los electrones se desplazan hacia el elemento de
mayor carácter no metálico.
Se
puede representar mediante una estructura de Lewis en la que el par
de electrones enlazante está más próximo al Cl que al H.
Se
dice que hay una separación de carga con una carga parcial
positiva (δ+) sobre el H y una carga parcial negativa (δ-) sobre
el Cl.
Electronegatividad
(EN)
Describe
la capacidad que tiene un átomo para competir por los electrones con
otros átomos a los que está unido.
La
electronegatividad está relacionada con la Energía de
Ionización (I) y la afinidad
electrónica (AE).
Una
escala de electronegatividad muy utilizada fue diseñada por
Pauling:
*Los
valores van desde 0,7 (Cs y Fr) hasta 4,0 (F).
*Cuanto
más pequeño es el valor de EN, más metálico es el elemento.
*Cuanto
más grande es el valor de EN, menos metálico es el elemento.
A
partir de la diferencia de electronegatividad (ΔEN),
que es la diferencia en valor absoluto de EN de los átomos
enlazados describir la polaridad de un enlace covalente.
-Si
ΔEN es muy pequeño, el
enlace es esencialmente covalente.
-Si
ΔEN es grande, el
enlace es esencialmente iónico.
-Para
valores intermedios de ΔEN, el
enlace se considera covalente polar.
Escritura
de las estructuras de Lewis
Hay
que tener en cuenta:
-Todos
los electrones de valencia
de los átomos de una estructura de Lewis deben
aparecer en ella.
-Generalmente,
todos los electrones están apareados.
-Generalmente,
cada átomo requiere un octeto
(excepto el H).
-Algunas
veces son necesarios enlaces covalentes múltiples.
-Los
átomos C, N, O, P y S son los que más fácilmente forman
enlaces covalentes múltiples.
Cargas
formales (CF)
Son
cargas aparentes que aparecen sobre algunos átomos de una estructura
de Lewis cuando los átomos no han contribuido con igual número de
electrones al enlace covalente que los une.
Es
el número de electrones de valencia en el átomo menos el
número de e asignados a ese átomo en la estructura de Lewis.
*Los
e de los pares solitarios se cuentan como pertenecientes por
completo al átomo en que se encuentran.
*Los
e de los pares de enlace se dividen por igual entre los átomos
enlazados.
CF
= e de valencia en el átomo libre – e del par solitario –
(e de enlace)/2
|
Reglas
generales para ver si una estructura es aceptable:
1.
La suma de las cargas formales es igual a la carga total de la
molécula o el ion.
2.
Si son necesarias cargas formales, éstas deben ser tan pequeñas
como sea posible.
3.
Las cargas formales negativa suelen aparecer en los
átomos más electronegativos y las positivas en los átomos menos
electronegativos.
4.
Las cargas formales del mismo signo en átomos adyacentes son poco
probables.
Comenzamos
por el esqueleto de la estructura:
Distinguir
entre los átomos centrales y los átomos terminales.
• Los
átomos de H son siempre átomos terminales.
• Los
átomos centrales suelen ser los de menor electronegatividad.
• Los
átomos de C son casi siempre átomos centrales. Ésta es una
característica común de moléculas orgánicas.
•Con
la excepción de moléculas orgánicas en forma de cadena, las
moléculas e iones poliatómicos tienen estructuras que suelen
ser compactas y simétricas.
Excepciones
a la regla del octeto
*Especies
con número impar de electrones (radicales):
*Octetos
incompletos:
Excepciones
a la regla del octeto
*Octetos
expandidos: Las estructuras
suelen estar formadas por átomos no metálicos situados a partir
del tercer periodo: P y S son muy comunes.
Tras
llenar las subcapas 3s y 3p del átomo central, los
electrones ocupan la subcapa vacía 3d.
Método
de la resonancia
El
oxígeno se presenta normalmente como molécula diatómica pero
también puede presentarse como molécula triatómica de ozono, O3.
Las
dos estructuras de Lewis presentan un enlace sencillo y uno doble, y
la evidencia experimental indica que ambos enlaces son
iguales, con una distancia intermedia entre el enlace doble y
sencillo, por lo que se dice que existe resonancia.
Se puede decir que los enlaces del ozono son
intermedios entre sencillos y dobles, es decir, enlaces 1,5.
La
verdadera estructura de Lewis no es ninguna de las dos sino un
híbrido de resonancia de las dos estructuras contribuyentes.
Geometría
molecular: modelo RPECV
La
geometría molecular se basa en la figura geométrica que
resulta de unir con líneas rectas los núcleos enlazados.
Así, definimos:
Longitudes
de enlace: distancias entre los
núcleos.
Ángulos
de enlace: ángulos entre
líneas adyacentes que representan los enlaces.
Teoría
RPECV (repulsión de pares de electrones de la capa de valencia):
• Los
pares de electrones se repelen entre sí, tanto si están en enlaces
químicos (pares enlazantes) como
si no están compartidos (pares solitarios).
Los pares de electrones se disponen alrededor de un
átomo con orientaciones que minimicen las repulsiones.
•
Geometría
de grupos de electrones: distribución
de los pares de electrones.
•
Geometría
molecular: distribución de los
núcleos.
¿Cómo
aplicamos la teoría RPECV?
Escriba
una estructura de Lewis aceptable.
Determine
el número de grupos de electrones que hay alrededor del átomo
central (A) y establezca si
son grupos enlazantes (X)
o pares solitarios (E).
Los
enlaces múltiples cuentan como un solo grupo de electrones.
La
notación será AXnEm.
Establezca
la geometría de grupos de electrones: lineal,
trigonal-plana, tetraédrica, bipiramidal trigonal, octaédrica.
Determine
la geometría molecular.
Pares
solitarios y geometría molecular:
Los
pares de e solitarios se extienden más que los pares de e
enlazantes.
El
orden de mayor a menor de las fuerzas repulsivas es:
*par
solitario - par solitario
*par
solitario - par enlazante
*par
enlazante - par enlazante
Geometría
de los pares de e-
Lineal
E+X=2
Trigonal
plana X+E=3
Tetraédrica
X+E=4
Bipiramidal
plana X+E=5
Octaédrica
X+E=6
Geometría
molecular
Lineal
AX2
Piramidal
trigonal AX3
Tetraédrica
Balancín
AX4E
Forma
de T AX3E2
Lineal
AX2E3
Pirámide
cuadrada AX5E
Plano
cuadrada AX4E2
Hibridación
sp
sp2
sp3
sp3d
“
“
sp3d2
Forma
de las moléculas y momentos dipolares
En
la molécula de HCl, el átomo de Cl es más electronegativo que
el átomo de H, así que los electrones están desplazados hacia
el átomo de Cl.
La
molécula de HCl es una molécula polar y la magnitud del
desplazamiento de la carga en un enlace covalente polar viene
dado por el momento dipolar, μ, que es el producto de la carga
parcial por la distancia:
-
Cuando
δ·q tiene un
valor de 3,34×10-30 culombio·metro, μ es
igual a 1 debye (D).
Moléculas
polares y no polares
Aunque
una molécula pueda tener enlaces polares, la suma puede ser cero. En
ese caso, la molécula no es polar, como en el caso del dióxido de
carbono.
Moléculas
polares μ ≠0
*Moléculas
diatómicas con enlace polar.
*Moléculas
poliatómicas que contienen enlaces polares/pares de e- libres
distribuidos de tal manera que no se cancelan.
Moléculas
apolares: μ =0
*Moléculas
diatómicas SIN enlace polar.
*Moléculas
poliatómicas que contienen enlaces polares/pares de e- libres que SE
ANULAN entre sí.
Orden
de enlace
Se
puede definir como el número de enlaces existentes entre dos átomos.
De
forma simple, un enlace simple, orden = 1, un enlace doble, orden = 2
y un enlace triple, orden = 3.
Cuanto
mayor es el orden de enlace, menor es la longitud de enlace y el
enlace es más fuerte.
De
acuerdo con las teorías cuánticas, el orden de enlace puede no ser
un número entero. Esto se debe a que según la teoría de los
orbitales moleculares, el orden de enlace se puede definir como el
resultado del siguiente cálculo: 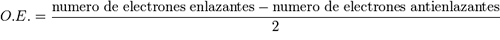
Se
forman OM enlazantes/antienlazantes a partir de orbitales atómicos.
Número
de orbitales moleculares (OM) = número de orbitales atómicos.
Los
electrones se colocan en los OM disponibles de energía más baja.
Se
cumple el principio de exclusión de Pauli y se sigue la regla de
Hund.
Las
especies estables tienen más electrones en los orbitales enlazantes
que en los antienlazantes.
Energía
de disociación del enlace
La
energía de disociación del enlace, D, es la cantidad de energía
necesaria para romper un mol de enlaces covalentes en una especie
gaseosa. Las unidades del SI son kJ/mol de enlaces.
Una
energía de enlace media es el valor medio de las energías de
disociación de enlace
de
varias especies distintas que tienen determinados enlaces.
Las
energías de enlace pueden servir para predecir si una
reacción será exotérmica (ΔH < 0) o endotérmica (ΔH >
0):
ΔH
= ∑energía de los enlaces formados - ∑energía de los enlaces
rotos
Teoría
del Enlace de Valencia
Cuando
se acercan dos átomos que inicialmente se encuentran muy alejados
uno de otro:
1.
Los electrones son atraídos por los dos núcleos.
2.
Los electrones se repelen unos a otros.
3.
Los dos núcleos se repelen entre sí.
Si
se representa la energía potencial en función de la distancia entre
los núcleos atómicos:
*Las
energías negativas corresponden a una fuerza atractiva
neta.
*Las
energías positivas corresponden a una fuerza repulsiva neta.
El
solapamiento de orbitales atómicos describe el enlace covalente.
El
área de solapamiento de los orbitales está en fase.
Se
trata de un modelo de enlace localizado.
Se
produce solapamiento entre los orbitales 1s del H y los
orbitales 3pz y 3px del S, quedando el orbital 3py con un par
de electrones sin compartir.
Hibridación
El
concepto del traslapo de los orbitales atómicos también se aplica a
moléculas poliatómicas. Sin embargo, un esquema satisfactorio del
enlace también debe explicar la geometría molecular.
Si
sólo se pudiesen utilizar orbitales p, los ángulos de enlace
serían siempre de 90°.
La
hibridación consiste en una operación matemática que combina
los orbitales atómicos para dar lugar a orbitales híbridos,
que están de acuerdo con la geometría molecular.
Los
cuatro orbitales de valencia del C se hibridan y se obtienen 4
orbitales híbridos sp3 degenerados.
Orbitales
híbridos: orbitales atómicos
que se obtienen cuando dos o más orbitales NO EQUIVALENTES se
combinan entre sí para prepararlos para la formación del enlace
covalente.
La
teoría de EV necesita conocer la geometría molecular de la
molécula. Normalmente se basa en la teoría RPECV.
El
proceso consiste en:
1.
Escribir una estructura de Lewis aceptable.
2.
Utilizar la teoría RPECV para predecir la geometría probable
de grupos de electrones.
3.
Seleccionar el esquema de hibridación correspondiente a
la geometría de grupos de electrones.
Teoría
de orbitales moleculares
La
teoría de enlace valencia es una de las dos propuestas de la
mecánica cuántica para explicar los enlaces en las moléculas.
Explica, al menos cualitativamente, la estabilidad del enlace
covalente en términos del traslapo de orbitales atómicos.
Utilizando el concepto de hibridación, la teoría de enlace valencia
puede explicar la geometría molecular predicha por el modelo RPECV.
Sin embargo, la suposición de que los electrones en una molécula
ocupan orbitales atómicos de los átomos individuales, es sólo una
aproximación, ya que cada electrón enlazante en una molécula debe
estar en un orbital característico de la molécula como un todo. En
algunos casos la teoría de enlace valencia no explica
satisfactoriamente algunas de las propiedades observadas de las
moléculas. Podemos resumir en que la TEV explica aspectos
cuantitativos, la forma de la molécula, pero la TOM explica aspectos
cuantitativos, referentes a la energía.
Los
orbitales atómicos están aislados en los átomos.
Los
orbitales moleculares abarcan dos o más átomos.
Se
expresan como combinación lineal de orbitales atómicos:
Un
orbital molecular de antienlace tiene mayor energía y menor
estabilidad que los orbitales atómicos que lo formaron. Como lo
indican los nombres de “enlace” y “antienlace”, el acomodo de
electrones en un orbital molecular de enlace produce un enlace
covalente estable, en tanto que el acomodo de electrones en un
orbital molecular de antienlace produce un enlace inestable.
En
los orbitales moleculares de enlace, la densidad electrónica es
máxima entre los núcleos de los átomos que se enlazan. Por otra
parte, en los orbitales moleculares de antienlace la densidad
electrónica disminuye hasta cero entre los dos núcleos.
El
enlace σ
es
un enlace que se forma entre dos átomos de un compuesto covalente,
debido a la superposición directa o frontal de los orbitales; es más
fuerte y determina la geometría de la molécula.
Traslapo frontal.
El
enlace Π
que se forma después del enlace sigma; es el segundo o tercer enlace
formado entre dos átomos, debido a la superposición lateral de los
orbitales “p”. Sus electrones se encuentran en constante
movimiento. Traslapo
lateral.
¿CÓMO
EXPLICA LA TEORIA DE ENLACE VALENCIA LOS ENLACES SENCILLOS, DOBLES Y
TRIPLES?
Un
enlace sencillo es el resultado del solapamiento de orbitales a lo
largo del eje internuclear (línea imaginaria que une los dos
núcleos). Este enlace se conoce como enlace sigma, y se obtiene del
pareamiento de electrones debido al solapamiento de dos orbitales
"s", o de un orbital "s" con un orbital Px, o de
dos orbitales Px, o de cualesquiera dos orbitales atómicos que se
solapen a lo largo del eje internuclear (eje de X).
En
un enlace pi se requiere del solapamiento de orbitales que
interaccionen fuera del eje internuclear, específicamente orbitales
'Py' y/o 'Pz' , que quedan perpendiculares al eje internuclear (eje
de X).
En
un doble y triple enlace, además del enlace sigma, se requiere de
uno o dos enlaces pi, respectivamente.
¿COMO
EXPLICA LA TEORIA DE ORBITALES MOLECULARES LOS ENLACES SENCILLOS,
DOBLES Y TRIPLES?
Por
la teoría de orbitales moleculares se entiende que el solapamiento
de los orbitales a lo largo del eje internuclear genera un orbital de
enlace llamado sigma . Por lo tanto, todo enlace sigma implica un
enlace sencillo y viceversa. En cada enlace sigma hay dos electrones
pareados. Su densidad electrónica es cilindricamente simétrica
alrededor del eje internuclear.
Para
el caso de enlaces dobles o triples, la teoría de orbitales
moleculares especifíca la formación de un orbital sigma y un
orbital "pi" para un doble enlace y de un orbital sigma y
dos orbitales "pi" para el triple enlace.
Un
orbital "pi" se genera por el solapamiento de los orbitales
que interaccionan fuera del eje internuclear: por lo general,
orbitales atómicos ''p''. Su densidad electrónica se ubica sobre y
debajo de este eje. Cada orbital posee un par de electrones pareados:
en este caso se produce un enlace pi.
(Sólo
se indican los orbitales de enlace; por conveniencia los orbitales de
antienlace no se ilustran. Los dos lóbulos que constituyen el
orbital molecular pi de enlace forman un sólo enlace).
La
teoría de orbitales moleculares es muy conveniente para explicar el
fenómeno de la deslocalización de electrones: electrones que pueden
enlazar más de dos átomos a la vez debido a que se encuentran en
orbitales moleculares deslocalizados, es decir, solapados y abarcando
varios átomos.
Si
el átomo central forma dobles enlaces, tendrá hibridación sp2. Si
forma un triple enlace, tendrá hibridación sp.