1.
Tipos de disoluciones
Las
disoluciones son mezclas homogéneas, con composición y propiedades
uniformes.
Están
formadas por:
•
Disolvente:
o Está presente en
mayor cantidad.
o Determina el estado
de la materia en la que existe una disolución.
•
Soluto:
o Otros componentes de
la disolución que están disueltos en el disolvente.
2.
Concentración
La
concentración es la medida de la cantidad de soluto presente
en una cantidad de disolvente o de disolución.
Se
puede expresar como:
Porcentajes:
•
Porcentaje en masa:
Gramos de soluto en 100 g de disolución.
•
Porcentaje en
volumen: Mililitros de soluto en 100 ml de disolución.
•
Porcentaje en
masa/volumen: Gramos de soluto en 100 ml de disolución.
Partes
por millón, partes por billón o partes por trillón:
•
ppm: gramos de
soluto en 106 g de disolución = mg de soluto / litro de agua.
•
ppb: gramos de
soluto en 109 g de disolución = μg de soluto / litro de agua.
•
ppt: gramos de
soluto en 1012 g de disolución = ng de soluto / litro de agua.
M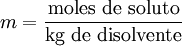 olaridad
(M)= moles de soluto / litro de disolución
olaridad
(M)= moles de soluto / litro de disolución
3. Interacciones en
disolución
Podemos dividir el
proceso de disolución en tres etapas:
1. Separación de las
moléculas del disolvente: requiere un gasto de energía (ΔHa>
0).
2. Separación de las
moléculas del soluto: requiere un gasto de energía (ΔHb>
0).
3. Interacción entre
las moléculas de disolvente y del soluto. Suele ser
exotérmica (ΔHc< 0), y será mayor o menor
dependiendo de las fuerzas intermoleculares.
Si
las fuerzas entre todos componentes son similares, prácticamente no
hay variación de energía al disolverse:
ΔHsol
≈ 0 → ΔHa
+ ΔHb=
–ΔHc
Éste
es el caso de las disoluciones ideales (p. ej. Tolueno : benceno).
Si
las fuerzas de cohesión (ΔHa+ ΔHb)
son menores que las de adhesión (ΔHc<
0) el proceso es exotérmico (ΔHsol < 0).
No
son disoluciones ideales. (P. ej. acetona en CHCl3).
Si
las fuerzas de cohesión son algo mayores que las de
adhesión, el proceso es endotérmico (ΔHsol
> 0). La disolución es posible por el aumento de la entropía y
son disoluciones no ideales. (P. ej. acetona en CS2).
Si
las fuerzas de cohesión son mucho mayores que las de
adhesión, el proceso es muy endotérmico (ΔHsol
> 0) y no se compensa con el aumento de la entropía. No se
produce la disolución y se obtienen mezclas heterogéneas. (P. ej.
octano y agua).
En el caso de
disoluciones iónicas, los dipolos de agua se disponen
alrededor de los iones en la superficie del cristal, le corresponde
una fuerza de atracción ión-dipolo. Si estas fuerzas superan las
fuerzas de atracción interiónicas del cristal, el sólido se
disuelve.
Las fuerzas ion-dipolo
sigue existiendo en disolución: los iones se encuentran
hidratados.
La hidratación de los
iones es un proceso exotérmico.
Si la suma de las
entalpías de hidratación es del orden de la energía de la
estructura cristalina, se producirá la disolución del cristal.
Para la mayoría de los
compuestos iónicos solubles en agua, ΔHsol > 0,
aunque su valor es pequeño.
4. Solubilidad
Una
disolución saturada
contiene la máxima cantidad de soluto que se disuelve en
ese disolvente a una
temperatura determinada. Se establece un equilibrio dinámico entre
las moléculas de sólido que se disuelven y las de soluto que
precipitan.
Una
disolución sobresaturada
contiene más soluto que el que puede contener un
disolvente: son situaciones
inestables.
Una
disolución insaturada si
contiene menos soluto que lo que es capaz de disolver.
La solubilidad depende
de la temp: curvas de solubilidad. No existe una relación clara
entre ΔHsol y la variación con la temperatura: las
curvas se obtienen experimentalmente.
Sólidos
En la mayoría de
los casos, la solubilidad de las sustancias iónicas aumenta
con la temperatura.
Proceso de separación:
cristalización fraccionada.
Gases
La solubilidad de los
gases en agua disminuye al aumentar la temperatura. Sin embargo,
en disolventes orgánicos la solubilidad suele aumentar cuando lo
hace la temperatura.
Ley
de Henry: La solubilidad
de un gas en un líquido es proporcional a la presión del gas
sobre la disolución.
|
La solubilidad
aumenta si el gas reacciona con el disolvente (por ejemplo
CO2 en agua u O2 en sangre).
5.
Disolución ideal y desviaciones.
*Presión de
vapor de las disoluciones.
Cuando las moléculas
se evaporan en un recipiente, la presión del vapor es lo
suficientemente alta para que las moléculas del vapor vuelvan al
líquido, por lo que se establece un equilibrio constante. Todo
líquido a una cierta temperatura puede establecer un equilibrio
dinámico entre las moléculas que pasan de líquido a vapor y las
que pasan de vapor a líquido. La presión
de vapor es la presión ejercida por el líquido
evaporado a una determinada temperatura, es decir, depende del
tipo de líquido y temperatura. La
presión de vapor nos indica la temperatura de ebullición.
*Ley de Raoult:
Un soluto no volátil
disuelto disminuye la presión de vapor del disolvente (Pa0):
Si en un sistema
tenemos soluto y disolvente, la presión ejercida por el líquido
debe ser multiplicada por la fracción molar, para conocer
verdaderamente la presión de éste y no la del soluto, ya que esta
última no se incluye en la Presión de vapor.
Si tenemos dos
líquidos, cada líquido va a ejercer su propia presión. Por tanto,
en caso de que el soluto sea volátil la Presión de vapor va a ser
la suma de las presiones parciales de cada uno de los componentes.
*Las disoluciones
ideales (la minoría) cumplen la ley de Raoult siempre.
*Las disoluciones no
ideales sólo la cumplen cuando son diluidas (xB <
0,02).
Se puede representar
cómo varían las presiones de vapor dependiendo de la composición
(a una temperatura determinada):
En caso de que las
fuerzas de cohesión predominen, las moléculas están menos
retenidas por el disolvente, y más entre sí, por lo que la
volatización es más fácil y la desviación postiva,
En caso de que las
fuerzas adhesivas predominen, las moléculas se verán más retenidas
por el disolvente, por lo que la volatilización es más difícil, y
la desviación negativa.
Cuando la presión de
vapor iguala a la temp atmosférica el líquido hierve, por lo que
también se puede representar cómo varía el punto de ebullición
a una determinada presión (normalmente 1 atm).
En la zona entre el
líquido y el vapor (zona rosa) coexisten las dos fases, pero no
están en equilibrio (ebullición).
Cuando tenemos una
mezcla 50:50 y empieza a hervir, el vapor se enriquece en el
componente más volátil (sigue la línea superior) y el líquido en
el menos volátil (sigue la línea inferior). La gráfica te indica
la composición exacta de cada uno a determinada temperatura .A
medida que se evapora, el líquido tiende hacia la línea de arriba y
el vapor hacia abajo.
En el punto de arriba
(donde sale la flecha de vapor) la disolución se ha evaporado
totalmente. La idea es que la evaporación no ocurre de una sola vez,
sino que sucede poco a poco.
Esto permite separar
líquidos por destilación. La destilación fraccionada consiste en
sucesivas destilaciones que permiten aumentar la pureza de los
líquidos separados.
6. Propiedades
coligativas de las disoluciones de no electrolitos
Propiedades
coligativas: aquellas que dependen del número de partículas del
soluto y no de su naturaleza.
La
presión de vapor disminuye
cuando está presente un soluto no volátil. Esto se manifiesta en:
o Una elevación del
punto de ebullición: aumento ebulloscópico.
o Una disminución del
punto de congelación: descenso crioscópico.
En disoluciones
diluidas se cumple:
Kf es la
constante molal de la disminución del punto de congelación.
Ke es la
constante molal del aumento del punto de ebullición.
M es la molalidad de la disolución.
M es la molalidad de la disolución.
NOTA: Se utiliza
molalidad porque no varía con la temp, mientras que la molaridad
varía con la temp, porque varía el volumen.
La diferencia en la
presión de vapor se pone también de manifiesto si se hace el
siguiente experimento:
• Ponemos dos
disoluciones acuosas de diferentes concentraciones de un soluto no
volátil en un recinto cerrado.
• La presión de
vapor del más diluido es mayor que la del más concentrado, porque
puede evaporarse más líquido.
• El vapor irá
condensando en la disolución más concentrada hasta que se igualen
las concentraciones.
• Esto puede ocurrir
en algunos sólidos: toman la humedad del aire y se van diluyendo.
Dependiendo de la
concentración, las moléculas pueden escapar de una disolución a
otra hasta que se igualen. La más diluida disminuirá el volumen
para equilibrar la concentración. Este fenómeno se llama
delicuescencia.
Si las dos disoluciones
están conectadas a través de una membrana semipermeable, no hace
falta que el disolvente pase a vapor.
Se produce un flujo
neto de moléculas de agua desde la disolución más diluida a la más
concentrada, denominado ósmosis.
El agua se difunde a
través de la membrana hasta que la diferencia de altura de líquido
iguala el flujo en el sentido contrario.
La presión necesaria
para detener el flujo osmótico se denomina presión osmótica
(π). π = MRT

Si se aplica una
presión sobre la disolución concentrada, se obliga a las moléculas
de agua a pasar a la más diluida: ósmosis inversa. Se utiliza para
obtener agua potable a partir de agua del mar.
7. Disoluciones de
electrolitos
¿Cuál sería el
descenso crioscópico de una disolución acuosa de 0,0100 m de urea?
ΔT f= -Kf · m = -1,86
°C·kg·mol-1 · 0,0100 kg·mol-1 = -0,0186 °C
Experimentalmente se
obtiene que cuando en lugar de urea, es NaCl, ΔTf = -0,0361 °C
Los electrolitos dan
lugar a propiedades coligativas anómalas.
Se define el factor
i de Van’t Hoff como la relación entre el valor experimental y
el esperado si la disolución fuese de no electrolitos:
Las
expresiones de ΔTf y π se modifican multiplicándolas por i.
Según Arrhenius,
un electrolito fuerte (p. ej. NaCl o MgCl2) se disociará
completamente en iones y cada uno se comportará como un soluto: i
valdría 2 (NaCl) y 3 (MgCl2).
Experimentalmente se
encuentra que esto sólo se cumple en disoluciones diluidas.
A medida que aumenta la
concentración de electrolitos, los iones no se comportan de forma
independiente uno de otro.
Cada ion está rodeado
por otros de carga opuesta (atracciones interiónicas).
La movilidad de cada
ion se reduce debido a la atracción o dificultad para moverse que
ejerce su atmósfera iónica.
Se puede decir que cada
tipo de ión tiene dos concentraciones:
*Una concentración
estequiométrica.
*Una concentración
efectiva, denominada actividad, que tiene en cuenta las
atracciones entre iones.
La actividad de una
disolución está relacionada con su concentración estequiométrica
a través de un factor denominado coeficiente de actividad(γ).

No hay comentarios:
Publicar un comentario